快新聞/聯亞疫苗未過EUA 將在印度做三期臨床試驗
疫情指揮中心今宣布,聯亞「UB-612新冠肺炎疫苗」因中和抗體效價偏低,昨專家召開會議結果,沒有通過緊急使用授權(EUA)。其中,與會專家出席計22人,除了主席不參與投票外,21人投票結果為4人補件再議, 17人不同意通過,建議不予核准專案製造。不過,聯亞公司已規劃於印度展開第三期臨床試驗。
食藥署長吳秀梅表示,8月15日邀請國內化學製造管制、藥學、毒理學、臨床醫學、公衛、法律及醫學倫理專家召開會議,討論「聯亞UB-612新冠肺炎疫苗」專案製造申請案。
當日會議經過充分的審查與討論,聯亞疫苗的臨床試驗結果顯示,該疫苗安全性可接受,具細胞免疫反應趨勢,但中和抗體數據與國人接種AZ疫苗外部對照組的中和抗體數據相比,未能達到食藥署於110年5月28日專家會議所訂定的2項國產疫苗EUA療效評估基準。
吳秀梅指出,會中經投票表決,與會專家出席計22人,除了主席不參與投票外,21人投票結果為4人補件再議, 17人不同意通過,建議不予核准專案製造。此外,聯亞公司已規劃於印度展開第三期臨床試驗。
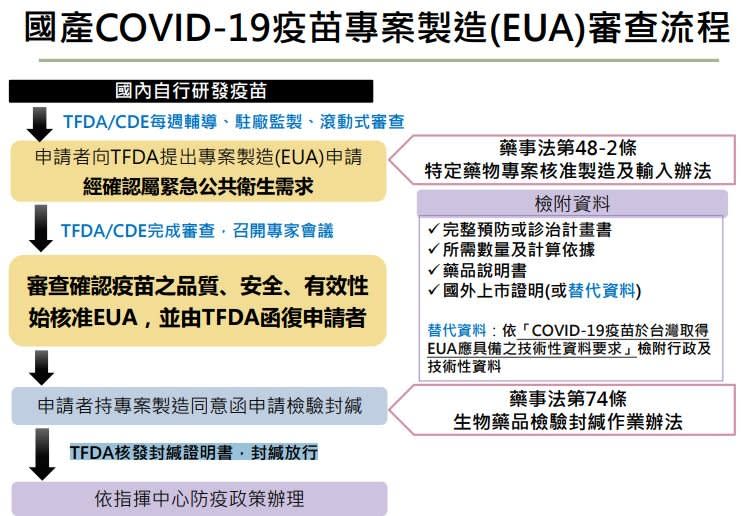
食藥署人員並說明新冠肺炎疫苗EUA審查說明流程,申請者向食藥署提出EUA申請,須檢附完整預防或診治計畫書、所需數量及計算依據、藥品說明書、國外上市證明或替代資料。替代資料是指依「COVID-19疫苗於台灣取得EUA應具備之技術性資料要求」檢附行政及技術性資料。
申請者提出申請後,經確認屬緊急公共衛生需求,食藥署召開專家會議審查,確認疫苗之品質、安全、有效性 始核准EUA,並由食藥署函復申請者,申請者持專案製造同意函申請檢驗封緘,最後食藥署核發封緘證明書,封緘放行。

更多民視新聞報導
快新聞/喊3次「陳時中下台!」 江啟臣批陳防疫破口、蘇貞昌「頭殼壞掉」
文策院跨海辦活動 邀唐鳳推廣台灣文化
快新聞/蘇貞昌與綠委達共識 免費五倍券估10月初發行

 Yahoo奇摩新聞
Yahoo奇摩新聞 