聯亞疫苗二期報告「對Delta變異株有效」!將於印度推動三期,力拚7月開打
「聯亞解盲了嗎?」先前眾說紛紜,今(27日)晚間六點,聯亞舉行線上重大訊息記者會,公布答案為「二期期中分析報告」!聯亞表示,將立即申請台灣緊急使用授權(EUA),並希望於7月下旬取得核准,開始為國內提供疫苗。
今年2月初開始,聯亞在全台的北中南共12家醫院,展開二期臨床收案,總共收案4142人,超過原來預期的3850人。其中,65歲以上族群收案占844位,也超過衛福部所規定的受試者人數。
記者會開始,聯亞表示,本次的臨床試驗,共計涵蓋4142名有效受試者,並以所有受試者兩劑疫苗施打完成後一個月,以及中位數受試者完成疫苗施打後兩個月的數據,進行安全性與免疫生成性評估。
聯亞:二期期中成效良好,可對抗印度變種病毒
聯亞藥業副總兼發言人范瀛云指出,此臨床試驗已於6月10日,達到所有受試者第二劑疫苗施打後一個月,以及於6月16日「中位數受試者」追蹤兩個月的期間分析條件。受試者血清也依照官方要求,由第三方臨床試驗機構檢測中和抗體效價,並已完成檢測。
與兩周前的高端解盲記者會雷同,聯亞生技本日同樣公佈了疫苗在「安全性」與「免疫生成性」的數據結果。
數據顯示,在這兩項指標上,安全性數據部分,受試者接種局部不良反應,注射處疼痛的比率,疫苗組為 64.59%,安慰組為 23.33%;注射處紅腫的比率,疫苗組為 34.06%,安慰組為 5.61%;發燒的比率,疫苗組為 1.93%,安慰組為 1.81% 。
免疫原性反應方面,抗體效價在施打第二劑後 28 天之血清陽轉率,成年組 (19 至 64 歲) 陽轉率達 95.65%;於年長者 (65 歲以上) 陽轉率達 88.57%;中和抗體效價為 102.3,與一期臨床試驗結果相近且符合預期。
此外,聯亞生技董事長特助彭文君更表示,從一期受試者檢體分析顯示,聯亞疫苗在誘導中和抗體上,對於所有的新冠變種病毒株,都能保有一定水平的保護莉,其中當然也包含印度 Delta 變異株。
聯亞新冠肺炎疫苗期間分析數據:
1.安全性、耐受性:
所有受試者未出現疫苗相關嚴重不良反應。
2.免疫生成性:
▋19至64歲成年組達95.65%。
▋65歲以上年長組,達88.57%
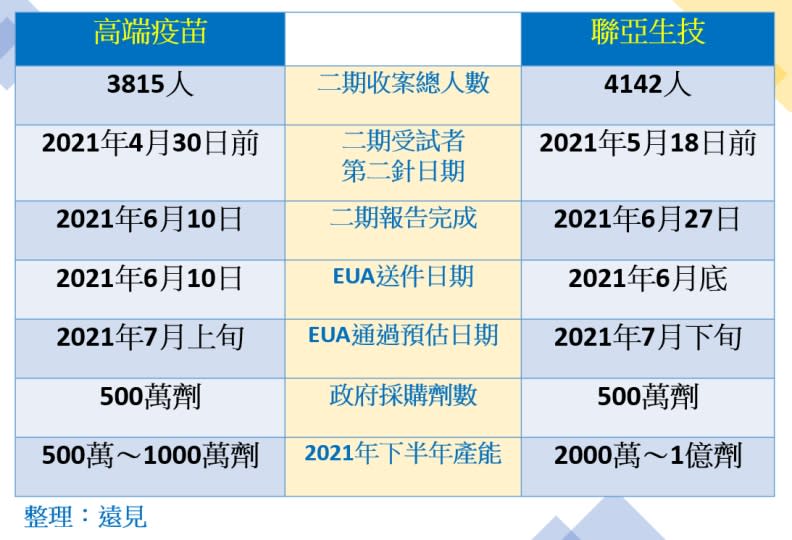
聯亞、高端新冠疫苗期程比較。蔣濬浩整理、林讓均製圖。
申請EUA,同步進行印度三期、美國混打二期
在二期臨床解盲之後,聯亞的下一步,也將循「高端模式」,以「免疫橋接」的方式,來決定能否通過食藥署的「緊急使用授權」(EUA)。
所謂「免疫橋接」,就是以「中和抗體效價」,來衡量疫苗所誘發的保護效果,而根據食藥署的規定,國產疫苗二期臨床試驗的中和抗體效價,必須得優於AZ疫苗,才算是具有足夠的保護力。
但不少醫師也強調,做完二期臨床試驗,僅能證明國產疫苗的「安全性」和「免疫生成性」;要確保疫苗「保護力」足夠,只有實施更大規模的「三期臨床試驗」才能客觀呈現,「中和抗體效價」也僅僅是保護力的觀察指標之一。
不過,范瀛云也補充,聯亞將持續於印度進行受試人數達1.1萬的三期臨床試驗;今年二月起,已與美國University of Nebraska Medical Center(UNMC)合作展開「疫苗混打」二期臨床試驗,讓曾接受輝瑞、莫德納、嬌生疫苗接種者,追加施打聯亞疫苗,也為未來可能的混打政策,超前部署。
食藥署也對此爭議表示,以AZ中和抗體效價作為國產疫苗的檢核標準,僅是國際標準公布前的暫定規章,若未來WHO訂出了國際共同遵循的中和抗體保護力指標,一切也都以WHO為準。
本文轉載自遠見雜誌

 Yahoo奇摩新聞
Yahoo奇摩新聞 
