高端獲EUA前就送驗遭質疑 陳時中:加速行政流程、累積50到60萬劑開放施打

衛福部食藥署2日宣布,首4批高端疫苗已完成檢驗並核發封緘證明書,共有26萬5528劑正在進行封緘作業,效期為6個月,預計傍晚可放行。對此,陳時中也在疫情記者會上解釋,為何高端疫苗可提前量產上市。
食藥署今日公布核發高端疫苗封緘證明書,但外界質疑,為何高端拿到EUA(緊急使用授權)前就送驗。指揮官陳時中今日解釋,為了因應疫情,在法規內讓行政流程加速,申請EUA前會要求廠商先把產品做出來並量產,政府再EUA,但EUA若沒過,或是查驗不過,那些錢政府都會吸收,算在簽約金裡。
陳時中強調,針對疫苗研發,各國其實都是採用事前就開始投資的方式,像美國直接釋放一大筆錢給藥廠,要求藥廠加速做,損失算國家的;第二個使用相關預採購,幫廠商分擔風險,預先簽約後就先付20%~40%不等的訂金,如果失敗,簽約金就算投資研究研發,成功了就往下繼續,運用這些方式分散財務風險,要求廠商能加速做疫苗。
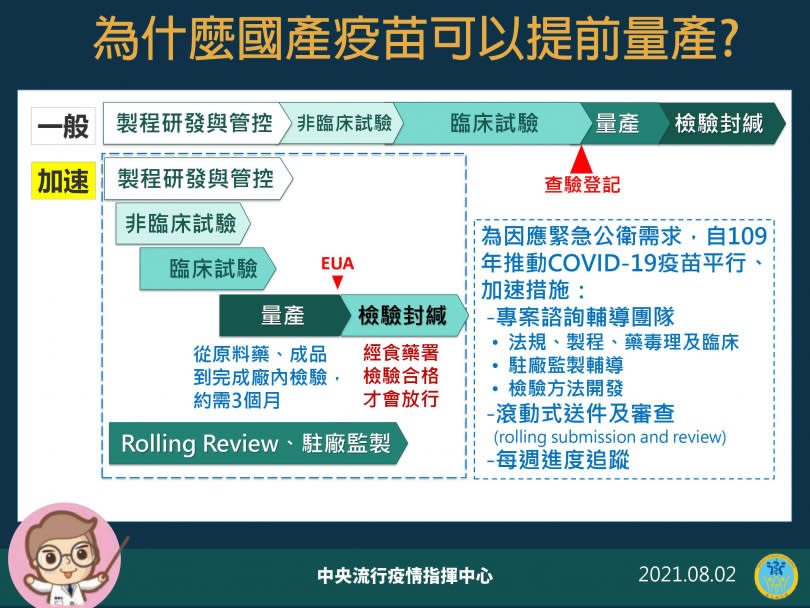
陳時中指出,這算是「預採購」,來幫廠商分擔分產,因為如果等EUA過了,才開始採購原料、量產,又要多花半年,EUA過了之後,都會每批檢驗,檢驗過了才會上市。週六封籤26萬劑,廠商會繼續送,但還不確定何時能開打,因為26萬劑還不夠分配,但若累積到到50到60萬劑就會開放施打。另外,當確定要施打高端的人超過250萬人就會再加購。
高端研發的COVID-19疫苗於7月間通過衛福部食藥署EUA,並陸續將生產的疫苗送到食藥署進行檢驗封緘,由於此為國內首支蛋白質疫苗,檢驗項目也和現有其他類型疫苗不同,光是檢驗就得耗時30天。陳時中表示,為了加速EUA進行,各國也都採用很多方法,把一些行政流程簡化,台灣從去年起就有專案輔導團隊針對申請EUA專案輔導計畫,直接可開會討論校正相關資料,讓整體流程能更順暢,主要都是在法規內讓行政流程更迅速。陳時中也強調,高端雖然先行量產,但政府的檢驗封緘很嚴格,每一個疫苗產品送來驗時批號都是連貫的,出貨中間有跳號狀況,就是因為技術性資料不齊全,要等廠商完成補件後再進行檢驗。
看更多 CTWANT 文章
中華隊賽程進入尾聲 三項目有望奪牌一次看
0死亡!新增12例本土2境外 分布5縣市曝光
陳建州賀戴資穎奪銀牌!被抓包「遮掉台灣國旗」 經紀人還原真相

 Yahoo奇摩新聞
Yahoo奇摩新聞 