國衛院發現新冠病毒快速感染機制 有助研發藥物與疫苗
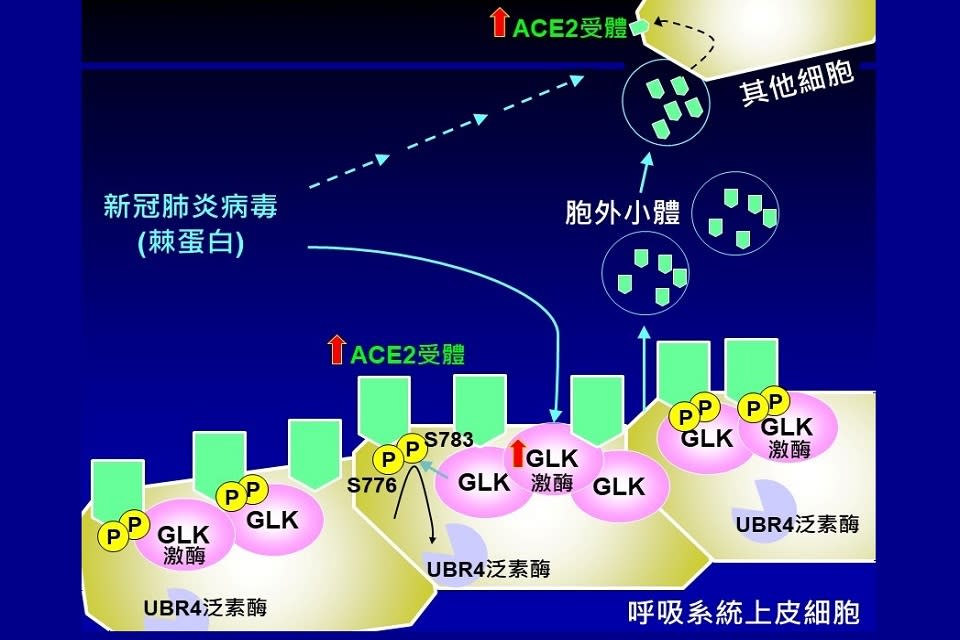
新冠肺炎疫情爆發至今已有兩年多,在全球蔓延造成高達5.8億人感染,6百多萬人死亡。國衛院表示,新冠肺炎病毒在進入人體後,主要藉由病毒表面的棘蛋白與人類呼吸系統上皮細胞表面的ACE2受體結合感染細胞,然而正常上皮細胞其實只有表現低量的ACE2蛋白,卻在感染後迅速誘發急性嚴重的呼吸道症狀,若能找出它快速傳播的機制,就有機會找到降低傳染的方法與策略。
國衛院免疫醫學中心譚澤華特聘研究員與莊懷佳助研究員團隊研究發現,受新冠病毒感染細胞中的蛋白激酶MAP4K3 (又稱GLK)表現量較正常細胞多,且GLK高量表達的上皮細胞比例與疾病嚴重度正相關。研究團隊與國衛院感染症與疫苗研究所周彥宏研究員合作,運用活體新冠病毒小鼠實驗證實,這感染機制是新冠病毒可大幅感染的關鍵,同時也能解釋新冠疫苗造成副作用的機制。研究成果於今(111)年7月發表於全球知名醫學期刊《EMBO Molecular Medicine》。
研究團隊分析COVID-19病患檢體的單細胞RNA定序結果,意外發現新冠病毒進入宿主上皮細胞後,棘蛋白會誘發蛋白激酶GLK高量表現,讓接收了ACE2蛋白的細胞更容易被新冠病毒所感染。研究人員分析COVID-19病患的血清檢體相較正常人的檢體,也發現GLK磷酸化的ACE2蛋白以及裝載著ACE2蛋白的胞外小體大幅增加。這些研究成果證實蛋白激酶GLK過量表現為COVID-19致病機轉之關鍵因子,同時說明新冠病毒快速引發臨床症狀且容易傳播的原因。
研究團隊運用小鼠模式進行動物實驗,當利用GLK的小分子抑制劑(verteporfin)可調降細胞表面ACE2蛋白量,並降低ACE2胞外小體的產生,進而成功抑制小鼠新冠肺炎病毒感染率。而小分子抑制劑與其它可調控GLK及ACE2相關的藥物,皆有可能成為抑制新冠病毒感染的候選藥物。
此外,本項研究成果也解釋了新冠肺炎疫苗產生副作用的機制。新冠肺炎疫苗中主要成分為棘蛋白或棘蛋白RNA,棘蛋白也可能會刺激誘發免疫細胞產生過量GLK,而導致強烈的發炎反應,造成疫苗的副作用。
國衛院期待透過進一步解開疾病致病機制,幫助治療藥物與疫苗的研發與篩選,開發緩解疾病症狀的新穎醫療方式。

 Yahoo奇摩新聞
Yahoo奇摩新聞 