藍委質疑高端流感疫苗臨床試驗不全 食藥署:韓國數據能代表亞洲人
國民黨立委王鴻薇昨日提出質疑,高端流感疫苗臨床試驗僅針對20至50歲進行試驗,又以機密理由拒公開韓國GC公司的疫苗資料,如何讓人民相信?食藥署副署長陳惠芳今(10/18)日表示,高端有檢附韓國第一期到第三期臨床試驗,等於有亞洲人種資料,因此認為可支持其療效及安全性,無須在我國執行全年齡層臨床試驗。
陳惠芳今日在例行記者會上說明,對於四價流感疫苗查驗登記,都一定要審核通過確保品質有效性才會核發許可證,臨床試驗並未限定試驗執行地點,而是視廠商所附整體臨床試驗數據結果進行審查其療效及安全性。
陳惠芳指出,依據ICH E5所訂的銜接性試驗基準審視該藥品是否具有族群差異,若經評估無族群差異者,得引用國外臨床試驗數據資料,未要求必須於我國執行臨床試驗或執行全年齡層臨床試驗,以減少重複進行臨床試驗。
陳惠芳舉例,像是跨國疫苗廠,以Covid-19疫情來說,因應疫情在不同國家原液做分裝充填,除非填充後跟原來不同,依照這樣的原則,所有疫苗案子審查都用同樣標準。
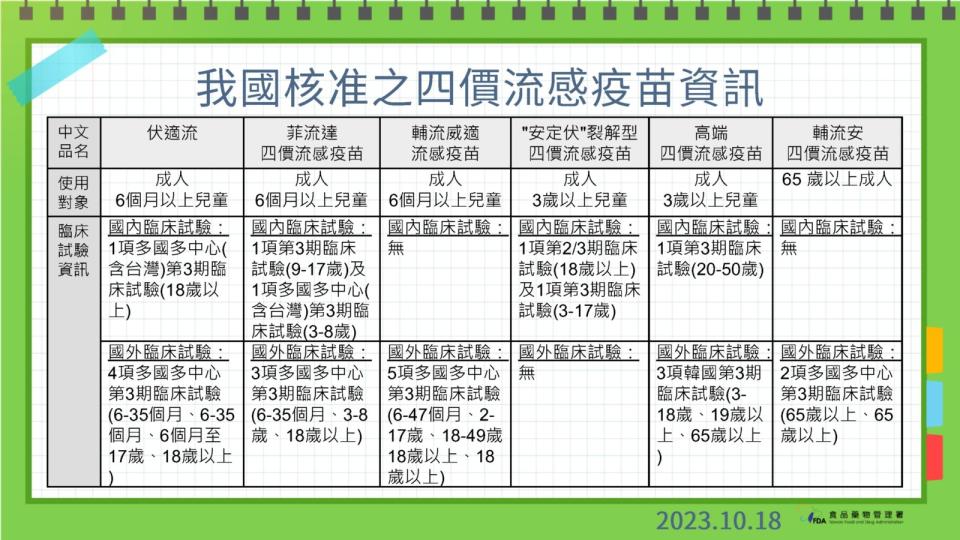
陳惠芳說,「高端四價流感疫苗」查驗登記案中,臨床試驗資料已檢附韓國執行的第一、第二期及第三期臨床試驗,受試者年齡包括3至18歲、19歲以上及65歲以上資料,也在我國執行第三期臨床試驗以受試者年齡:20至50歲。
因此,綜合韓國及台灣臨床試驗結果,陳惠芳指出,韓國等於有亞洲人種資料,沒有人種差異,國際上都是看人種差異,而非執行地點,因此認為可支持其療效及安全性,沒有要求全年齡層要在國內進行試驗。
至於為何不能提供臨床試驗資料?陳惠芳說依照藥事法第40-1條及營業秘密法第2條規定,藥品查驗登記時所檢附原始數據屬營業秘密資料,食藥署應保密,不過臨床試驗相關資料都有摘錄重點在仿單中,仿單可到許可證查詢系統查詢。
陳惠芳強調,所有核准的四價流感疫苗都是經由同樣標準審核,確認能達到有效性品質達一定規範才會放行,疫苗上市前一定要先檢驗、封緘才能放行供國人使用。
藥品組簡任技正黃玫甄也補充,國外數據完整情況下,可以直接引用國外數據申請許可證,只要有亞洲族群的數據就可以,不一定要做臨床試驗。
更多太報報導
看更多相關新聞
11月大男嬰染流感亡!醫示警4重症前兆:1狀況代表病情失控
去年感冒疫情反映在今年 醫:防感染用手揉鼻是大忌
拒打高端潮 醫院流感疫苗接種降速
高雄 秋冬好發哮吼 確診童咳嗽如狗吠
他吃完感冒藥竟尿不出來!醫提醒吃這6種藥物小心「急性尿滯留」

 Yahoo奇摩新聞
Yahoo奇摩新聞 